एक नए विश्लेषण से सी.वी.एस. की स्वयं की ब्रांड वाली दवाएं खरीदने के खतरों का पता चला है।
एफडीए के आंकड़ों से पता चलता है कि अमेरिका की सबसे बड़ी फार्मेसी श्रृंखला ने पिछले दशक में 133 ओवर-द-काउंटर दवाएं वापस मंगाईं, यानी हर महीने लगभग एक दवा वापस मंगाई।
यह संख्या उसके प्रतिस्पर्धी वॉलग्रीन्स से दोगुनी से भी अधिक थी, जिसने इसी अवधि में 70 रिकॉल किए थे, तथा वॉलमार्ट से तीन गुना अधिक थी, जिसने 51 रिकॉल किए थे।
सीवीएस द्वारा दवाओं को वापस मंगाने के कारणों में दवाओं में बैक्टीरिया का होना, फैक्टरी के वेंटिलेटरों में फफूंद का उगना, पेंट का उखड़ना, फैक्टरियों में नंगे पांव काम करने वाले कर्मचारी तथा गलत खुराक वाली गोलियां शामिल थीं।
पिछले दशक में सी.वी.एस. उत्पादों में स्वयं के ब्रांड की आई ड्रॉप्स को सबसे अधिक वापस बुलाए जाने की संभावना थी, इसके बाद स्वयं के ब्रांड की कब्ज की दवाएं – जैसे कि मैग्नीशियम साइट्रेट की गोलियां – तथा सर्दी-जुकाम और फ्लू के उपचार के लिए बनाई गई दवाएं शामिल थीं।
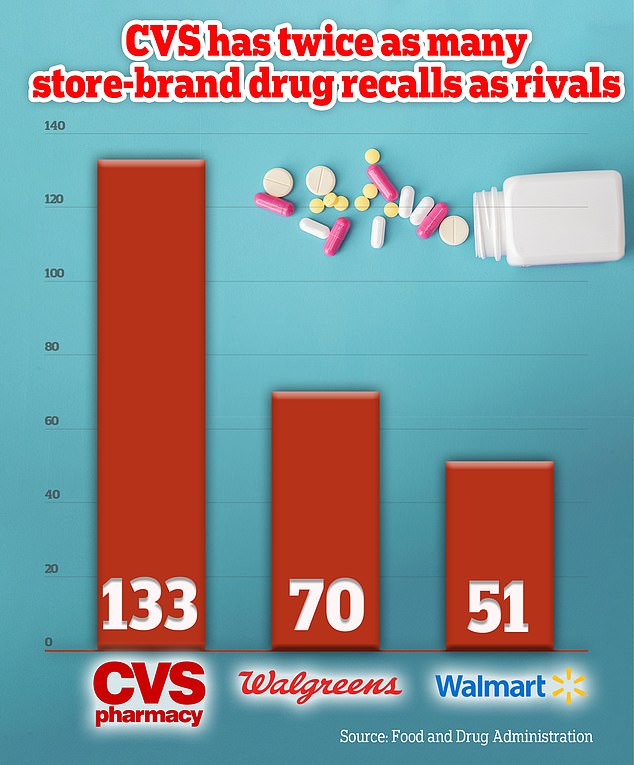
रिकॉल के विश्लेषण से पता चला है कि पिछले दशक में सीवीएस ने 133 रिकॉल दर्ज किए हैं, जो उसके दो निकटतम प्रतिद्वंद्वियों की तुलना में कम से कम दोगुना है

ऊपर की तस्वीर में किलिच हेल्थकेयर इंडिया लिमिटेड द्वारा संचालित फैक्ट्री है, जो सीवीएस सहित स्टोर्स पर बिकने वाली आईड्रॉप्स बनाती है, जहां कंपनी का लेबल भी लगा होता है
वापस बुलाए गए उत्पाद चीन और भारत स्थित कंपनियों द्वारा निर्मित थे, साथ ही कुछ अमेरिकी कंपनियों द्वारा भी निर्मित थे – जिनमें टेनेसी और फ्लोरिडा भी शामिल हैं।
सीवीएस ने हाल के वर्षों में अपने रिकॉल में वृद्धि देखी है, 2014 से 2018 तक प्रति वर्ष दस से भी कम रिकॉल दर्ज किए गए, लेकिन उसके बाद से छह वर्षों में से चार के लिए यह संख्या इस संख्या से अधिक रही।
इस वर्ष अब तक, श्रृंखला ने 11 रिकॉल दर्ज किए हैं – ज्यादातर आंखों की बूंदों, खांसी की दवाओं और कब्ज के इलाज के लिए दवाओं के लिए।
विशेषज्ञ कुछ समय से जेनेरिक दवाओं के बारे में चेतावनी देते रहे हैं, उनका कहना है कि फार्मेसी श्रृंखलाओं के लिए उनकी गुणवत्ता सुनिश्चित करने के लिए बहुत कम प्रोत्साहन हैं।
ऐसा FDA नियमों में एक खामी के कारण हुआ है, जिसके अनुसार CVS, तीसरे पक्ष के कारखानों द्वारा निर्मित जेनेरिक दवाओं की गुणवत्ता के लिए जिम्मेदार नहीं है, भले ही उन उत्पादों पर लाल दिल और 'CVS Well being' लिखा हो।
स्टैनफोर्ड विश्वविद्यालय के चिकित्सा विशेषज्ञ डॉ. केविन शुलमैन ने बताया, ब्लूमबर्ग'कम कीमत पर उत्पाद बनाने का सबसे अच्छा तरीका गुणवत्ता पर ध्यान देना है, और यही बात हम बार-बार देख रहे हैं।'
सीवीएस के प्रवक्ता ने एक बयान में कहा कि यह श्रृंखला – जिसके राष्ट्रीय स्तर पर 9,000 से अधिक स्टोर हैं – 'अच्छे विनिर्माण और नैतिक सोर्सिंग प्रथाओं' को प्राथमिकता देती है।
उन्होंने कहा कि सीवीएस ब्रांड 'गुणवत्ता और सुरक्षा को अधिकतम करने, अपेक्षानुसार काम करने, नियमों का पालन करने और ग्राहकों को संतुष्ट करने के लिए डिजाइन किए गए हैं।'
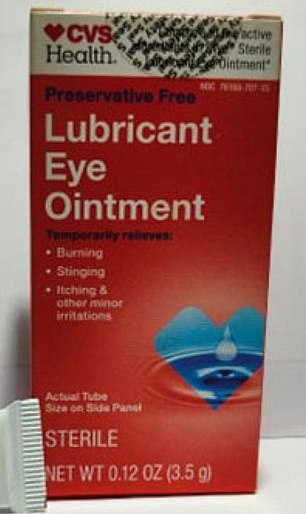

ऊपर दो सी.वी.एस.-ब्रांडेड उत्पाद दिखाए गए हैं जिन्हें संदूषण के कारण वापस मंगाया गया था। वे भारत में निर्मित नेत्र मरहम और टेनेसी में निर्मित कब्ज की गोलियाँ हैं

सीवीएस ने कहा कि उसके सभी ब्रांड की दवाइयां उच्च मानक पर निर्मित की जाती हैं
रिपोर्ट के अनुसार, इस वर्ष जनवरी में एक मामले में, भारतीय कंपनी द्वारा सी.वी.एस. के लिए बनाई गई एलर्जी की दवाओं को वापस मंगा लिया गया था, क्योंकि एफ.डी.ए. निरीक्षकों को भारत में दवा निर्माता की फैक्टरी में वायु शोधन इकाई के अंदर स्थिर तरल पदार्थ – जिसमें खमीर और फफूंद पनप रही थी – मिला था।
और पिछले साल अक्टूबर में एक दूसरी घटना में, जांचकर्ता भारत में सीवीएस आई ड्रॉप बनाने वाली एक फैक्ट्री में पहुंचे, जहां उन्हें पेंट उखड़ता हुआ और नंगे पांव काम करने वाले कर्मचारी मिले। FDA द्वारा की गई जांच में भी फर्जी परीक्षण के नतीजे सामने आए, जिससे फैक्ट्री के उत्पाद सुरक्षित प्रतीत होने लगे।
2022 के तीसरे मामले में, सीवीएस ने मैग्नीशियम साइट्रेट की गोलियाँ वापस मंगाईं – जो कब्ज के लिए इस्तेमाल की जाती हैं – क्योंकि उनमें सूक्ष्मजीवों द्वारा संदूषण पाया गया था। ये गोलियाँ टेनेसी स्थित कंपनी वी-जॉन द्वारा बनाई गई थीं।
2019 के चौथे मामले में, एफडीए निरीक्षकों ने पाया कि फ्लोरिडा में सीवीएस के लिए बच्चों की खांसी की दवा बनाने वाली एक फैक्ट्री में ऐसे बैक्टीरिया से संदूषित पानी का उपयोग किया जा रहा था, जो कमजोर प्रतिरक्षा प्रणाली वाले बच्चों के लिए घातक हो सकता है।
निरीक्षकों ने निर्धारित किया कि यूनिफार्मा एलएलसी नामक कंपनी, जो अब बंद हो चुकी है, बैक्टीरिया का पता लगाने वाले परीक्षण परिणामों की अनदेखी कर रही थी।
इस खोज के परिणामस्वरूप इसके सभी गैर-पर्चे उत्पादों को वापस बुला लिया गया। इसमें चेरी-स्वाद वाली बच्चों की दर्द और बुखार की दवा, मिश्रित बेरी-स्वाद वाली बच्चों की एलर्जी से राहत और अनानास-स्वाद वाली बच्चों की खांसी की दवा भी शामिल है।
उसी वर्ष सी.वी.एस. की स्वयं की ब्रांड इबुप्रोफेन गोलियों को भी वापस मंगाया गया, क्योंकि जांचकर्ताओं ने पाया कि गोलियों में लेबल पर बताए गए से अधिक मात्रा में दर्द निवारक दवा मौजूद थी।
सीवीएस अमेरिका में 2,000 से अधिक स्टोर-ब्रांड स्वास्थ्य और कल्याण उत्पाद बेचता है, अनुमान के अनुसार 2023 में स्वयं-ब्रांड बाजार का मूल्य 236 बिलियन डॉलर होगा।
यह कदम ऐसे समय उठाया गया है जब अमेरिका में फार्मेसियों में बेचे जाने वाले 26 से अधिक स्टोर-ब्रांड आई ड्रॉप्स को वापस मंगाया गया है, जिनमें राइट एड और वॉलमार्ट भी शामिल हैं।
ये बूंदें अंधेपन और घातक संक्रमणों से जुड़े बैक्टीरिया से संदूषित थीं, जिसके बारे में विशेषज्ञों का कहना है कि वह आंखों के माध्यम से 'गलने' में सक्षम है।
नेत्र-ड्रॉप्स के प्रयोग के बाद सेप्सिस से कम से कम चार लोगों की मृत्यु हो गई, जबकि 14 लोगों की दृष्टि चली गई तथा 80 से अधिक संक्रमण की सूचना मिली।